Tiefschlaf bei Leberzellen verhindert Krebs
 HZI
HZI
Braunschweiger Forscher haben einen Mechanismus entdeckt, mit dem sich Mäuse vor der Krebsentstehung schützen. Offenbar fallen gefährdete Leberzellen bei Mäusen in eine Art Tiefschlaf, bevor sie anfangen können, sich unkontrolliert zu vermehren. Die körpereigene Abwehr hält die schlafenden Zellen dann in Schach.
Die Wissenschaftler um Lars Zender, Leiter der Forschungsgruppe „Chronische Infektionen und Krebs“ am Helmholtz-Zentrum für Infektionsforschung in Braunschweig, konnten zeigen, wie das Immunsystem in Mäusen die Entstehung von Tumoren frühzeitig verhindert. Schon länger ist bekannt, dass Zellen am Ende ihres Lebenszyklus oder wenn das Erbgut geschädigt ist, ein fein abgestimmtes Selbstmordprogramm in Gang setzen. Der programmierte Zelltod, die Apoptose, lässt die Zelle absterben, noch bevor sie beginnt, sich unkontrolliert zu vermehren.
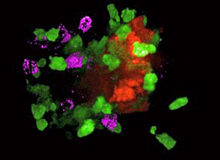
Die zweite Möglichkeit ist eine Art Tiefschlaf für die Leberzellen. Sie beenden dann ihren normalen Lebenszyklus und fallen in einen Ruhezustand, den die Wissenschaftler Seneszenz nennen.Gemeinsam mit Wissenschaftlern von der Medizinischen Hochschule Hannover und der ebenfalls in der niedersächsischen Landeshauptstadt ansässigen Twincore GmbH beobachtete Zender, wie das Immunsystem der Mäuse die seneszenten Zellen in Schach hält. Die körpereigene Abwehr stellt die Schläfer sofort unter verschärfte Kontrolle. „So verhindert der Körper, dass die Zellen sich weiter verändern und doch zu einem Krebs heranwachsen“, erklärt Zender.
Zellen künstlich in Schlafzustand versetzt
Um den Zusammenhang zwischen Seneszenz, Immunabwehr und Krebsentstehung zu untersuchen, lösten die Forscher um Lars Zender das Seneszenz-Programm in den Leberzellen von Labormäusen mittels molekularbiologischer Methoden aus. „Wir konnten deutlich sehen, dass das Immunsystem eine starke Reaktion gegen die veränderten Zellen startet“, so Zender. Die seneszenten Zellen werden sofort von den wesentlich kleineren Immunzellen angegriffen. Nach einigen Wochen sind die veränderten Zellen schließlich aus dem Körper entfernt.
Für die Mäuse ist dieser Mechanismus schlicht überlebensnotwendig. In Tieren, die wegen eines Gendefekts keine T-Helferzellen mehr besitzen, konnten die Forscher beobachten, dass sich die seneszenten Leberzellen zu einem Tumor entwickelten. „Das zeigt deutlich, wie wichtig die Überwachung der seneszenten Zellen durch das Immunsystem und speziell durch die Helferzellen ist“, sagt Zender.
HIV-Patienten mit erhöhtem Leberkrebs-Risiko
Das dieser Mechanismus auch beim Menschen eine Rolle spielen könnte, zeigen Untersuchungen an HIV-Patienten, bei denen ein erhöhtes Leberkrebs-Risiko besteht. Bei ihnen zerstört das HI-Virus einen bestimmten Typ von T-Helferzellen. Kann also auch ihr Immunsystem seneszente Leberzellen nicht mehr in Schach halten?
Um diese Frage zu klären, maßen die Forscher um Zender die Anzahl der seneszenten Zellen in der Leber von Hepatitis C-Patienten, die gleichzeitig HIV-positiv waren, und verglichen sie mit den Werten einer Vergleichsgruppe von Hepatitis C-Patienten ohne zusätzliche HIV-Infektion. „In der ersten Gruppe war die Zahl der seneszenten Zellen erwartungsgemäß stark erhöht“, so Zender. „Bei HIV-Patienten ist die Immunabwehr durch T-Helferzellen beeinträchtigt, sodass in Lebern von HIV-Patienten seneszente Leberzellen wahrscheinlich nicht effektiv entfernt werden können.“
Die Autoren der Studie hoffen nun, dass der neu entdeckte Mechanismus künftig neue Ansätze für die Prävention und Therapie von Krebserkrankungen ermöglichen wird.


